[無料ダウンロード! √] 水溶液 の 濃度 計算 767859-水溶液の濃度 計算
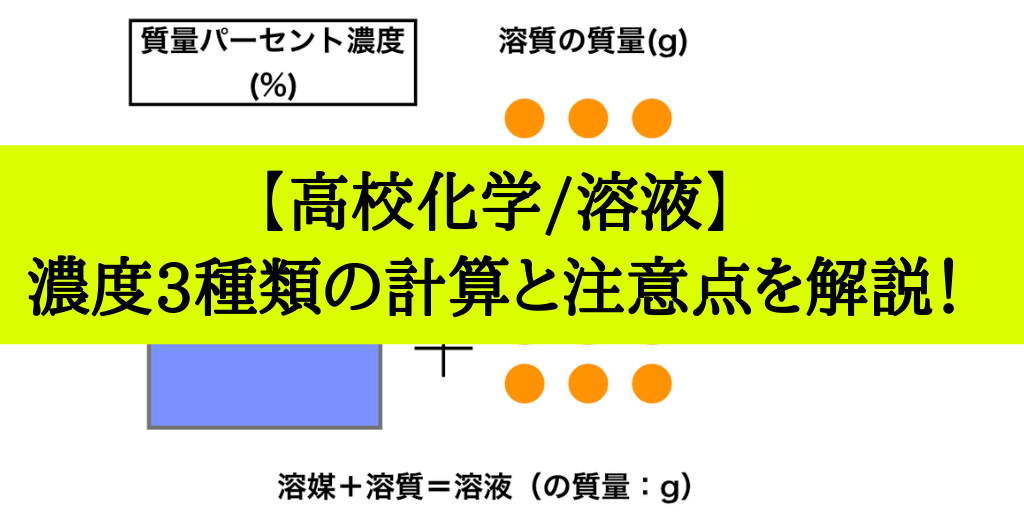
水溶液の濃度(質量パーセント濃度):公式と求め方 水溶液の濃さは溶質の質量を水溶液の質量で割って100をかけて求めます。 溶質の質量÷水溶液の質量×100 この値を質量パーセント濃度ともいいます。単に濃さという場合は、この質量パーセント濃度を指します。パーセントという名前がついているように単位はパーセントです。 · 2つの水溶液の食塩の質量が求められました。では混ぜた水溶液の数字を、公式にあてはめてやりましょう。 食塩の質量と、合計の食塩水の質量を足して求めれば、あとはいつも通りの計算。 食塩水の濃度は、 % になりましたね。溶液の濃度計算と調製方法のインターネットによる自動サービス -シュウ酸水溶液およびシュウ酸ナトリウム水溶液- 芦田実*,遠藤尊士,新保佳奈美 埼玉大学 教育学部 〒 埼玉県さいたま市桜区下大久保255 Email ashida@mailsaitamauacjp
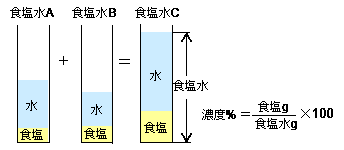
濃度算 混ぜる 高精度計算サイト
水溶液の濃度 計算
水溶液の濃度 計算- · 水の質量は8172 x = 約8165g で、合計すると 9752gとなる。 この時、アルコール度数%の水溶液は100ccであるので、9752g を100で割ると密度は、と計算できる。 国際アルコール表、つまりアルコール度数と密度の表から、水分 (体積%)、アルコールいろいろな物質 密度計算 水溶液 濃度溶解度計算 気体 状態変化 基本問題 いろいろな物質 密度計算問題 身の回りの物質 気体1 気体2 気体3 水溶液の性質 水溶液の性質2 濃度計算問題 アンモニアの噴水実験 メスシリンダーの使い方 標準問題




質量パーセント濃度の計算問題集 応用編 Menon Network
· Re気相濃度と水溶液の濃度の計算について Lake (ZWla752 水溶液濃度1ppmは重量分率、気相中濃度1ppmは体積分率、気体を理想気体と仮定すると体積は分子数(モル数)に比例する(もちろん温度、圧力一定で)・・・ この辺から計算式は作れ濃度未知の酢酸水溶液の濃度を調べるために,次のような中和滴定実験を行った。操作1~ 5 および結果1,2 に関する問1~問4に答えよ。ただし,シュウ酸は2 価の酸であり,また, 原子量はh=10,c=1,o=160 である。なお,問1~問3については有効数字3 桁で答 えよ。 (25点) 操作1 · 質量パーセント濃度の公式と計算問題の解き方 水85gに塩化ナトリウムを15g溶かした.水溶液の質量パーセント濃度は何%か 水は溶媒で85g,塩化ナトリウムは溶質で15g. これらを合わせると,塩化ナトリウム水溶液100gできます.
「水溶液250g の濃度が12%」=「水溶液250g のうち、12%が溶質(ここではホウ酸)である」という意味なので、 12 100 (250g の12%かけ算で表そう) 12 2 = 30 とすれば求められるよ。 この 溶液× (%) 100 = という形を公式のように覚えておくと便利かも!(数学でも使う機会があるよ溶質 · 水溶液の濃度 現在地 ホーム › 作成者 幅 賢策 作成日木, 06 小6理科計算特訓では、水溶液を用いた計算問題にチャレンジしています。 今日出てきた問題に、こんなものがありました。 60℃の水100gにホウ酸は149g溶けます。 (1) 60℃の水0gにホウ酸を25g加えて混ぜると、濃度は何 · 砂糖水の濃度を高めたい場合。 水溶液を熱して水だけを蒸発させれば、水だけなくなるので濃度が濃くなります。 まず、溶けている砂糖の質量を求めます 。 求めたい 「蒸発させる水の質量を xg」 とすると、 溶液は (500x) g;
濃度を計算する問題 2組の入口へ 説明へGO 1 水酸化ナトリウムの結晶gを水80gに溶解させ、水酸化ナトリウム水溶液を作る。この水溶液の密度を12g/cm 3 とするとき、以の濃度を求めよ。 (原子量H=10,O=16,Na=23) 1,質量パーセント濃度 2,モル濃度この砂糖水の質量パーセント濃度は何%か。 (3) 100gの水に60gの砂糖を入れてつくった砂糖水の質量パーセント濃度は何%か。 次の問いに答えよ。 (1) 質量パーセント濃度4%の塩化ナトリウム水溶液を250g作る場合 塩化ナトリウムは少なくとも何g必要か。濃度計算における基礎知識 溶液,溶質,溶媒とは? Ⅶ混合溶液の濃度タイプ ある濃度の水溶液に水を加えると溶媒が増加するので,濃度が小さく なるが,溶質の物質量(or質量)は薄める前後で全く変わらない。(右図参照) このことより,次の式を用いて解く。 「希釈前の溶液中の溶質の物質量(or



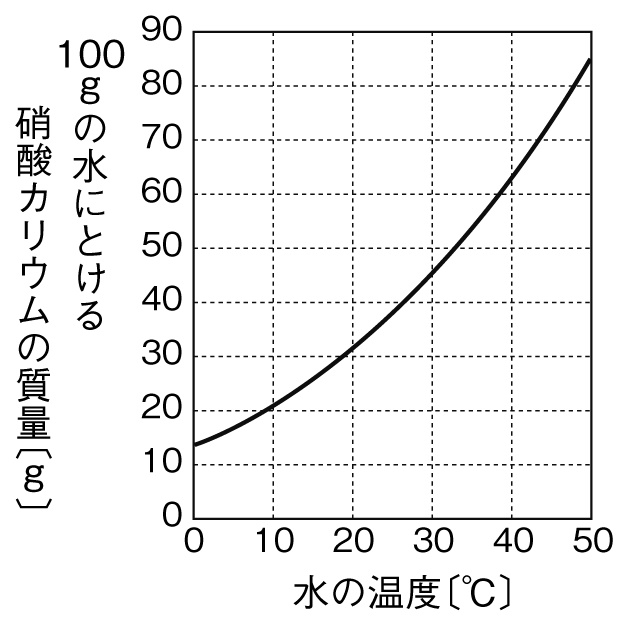
受験化学 9 溶解度の計算1 みかみの参考書ブログ



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee
濃度計算 H=10,C=12,N=14,O=16,Na=23,S=32,Cl=355, Ca=40 質量パーセント濃度 1 15% NaCl 水溶液100 g つくるには、NaCl は何g 必要か。 2 30% NaCl 水溶液 70 gつくるには、NaCl は何g 必要か。 3 05% Na2CO3 水溶液を500 g つくるには、Na2CO3 は何g 必要か。 容量モル濃度 4 水酸化ナトリウム80 g に水をその量は溶媒180gと溶質gであるとわかっているので、これを上で示した質量パーセント濃度の式に当てはめてみると、 ÷(180)×100=÷0×100=10 となり、この水溶液の濃度は10%と分かります。 単純な式なので、意外と簡単に解けたのではないでしょうか。(1) aの食塩=aの食塩水×aの濃度 (2) bの食塩=bの食塩水×bの濃度 (3) cの濃度=cの食塩÷cの食塩水 =(a+bの食塩)÷(a+bの食塩水)




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




理科 中1 27 質量パーセント濃度 Youtube
必要な原液量(mL)=希釈液の濃度(%) / 原液の濃度(%) × 作成する希釈液の量(mL) 必要な原液量(mL)=作成する希釈液の量(mL) / 希釈液の倍率 ※計算結果や情報等に関して当サイトは一切責任を負いません。また個別相談は対応しません。 お客様の声 アンケート投稿 よくある質問 リンク方法 洗 · 濃度未表記の輸入品ではなく濃度が明確なアルコール製品を販売したい、感染拡大防止に向けた商品にオリジナルのアルコール製品を採用したい、そのようなご要望があればこちらより是非お声掛け下さい。 ☞ エタノール水溶液密度換算(wt%, ℃ ⇒ g/cm3) · 水と塩、水溶液、濃度の計算 塩分濃度は、その水溶液に対して、 塩が何g含まれているかなので、下記のような式で表されます。 塩分濃度 (%) = 塩 / 水溶液 = 塩 / (水+塩) よって、100gの水に5gを溶かしても5%ではありません (476%)。




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月
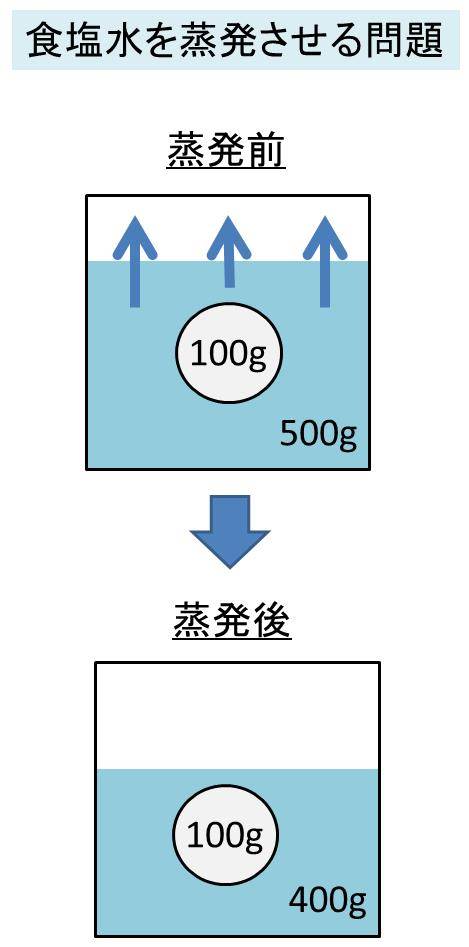



Spi 食塩水を蒸発させたときの濃度の計算方法 濃度算
· 濃度(%)=溶質の質量(g)÷ 溶液の質量(g)×100 濃 度 ( % ) 溶 質 の 質 量 ( ) 溶 液 の 質 量 ( ) 濃度(%)= 溶質の質量( g ) 溶液の質量( g ) × 100 · ホーム » 理科 » 化学 » 「濃度」の計算が苦手な方へ! 元研究員がわかりやすく解説 問題1 質量パーセント濃度15%の水酸化ナトリウム(NaOH)溶液の密度は10g /cm3 です。 この水溶液のモル濃度を求めましょう。 ただし、原子量 H=10 O=16 Na=23 とします · 溶質の質量の合計を出して、そいつを水溶液の重さの合計で割れば質量パーセント濃度が計算できるよ! リプトン より 17年9月28日 1248 AM




0g Descubre Como Resolverlo En Qanda




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン
ている。調製後の水酸化カリウムkohの濃度と 水溶液の体積から水溶液を調製するために必要 な水酸化カリウムの質量と溶解水の体積を求め る場合(図1)や、調製前の水酸化カリウムkoh の質量と溶解水の体積から水溶液の濃度を計算 · %の食塩水、 %の砂糖水といった、水溶液の「濃度」についての計算問題プリントです。 苦手な人が多いけど、しっかり身につけよう! 数学でも役に立つ場面があるよ(^ ^)ポイント 濃度の計算方法 ポイント 飽和水溶液と溶解度 ポイント 溶解度曲線と再結晶 会員登録をクリックまたはタップすると、 利用規約・プライバシーポリシー に同意したものとみなします。 ご利用のメールサービスで @tryitjp からのメールの受信
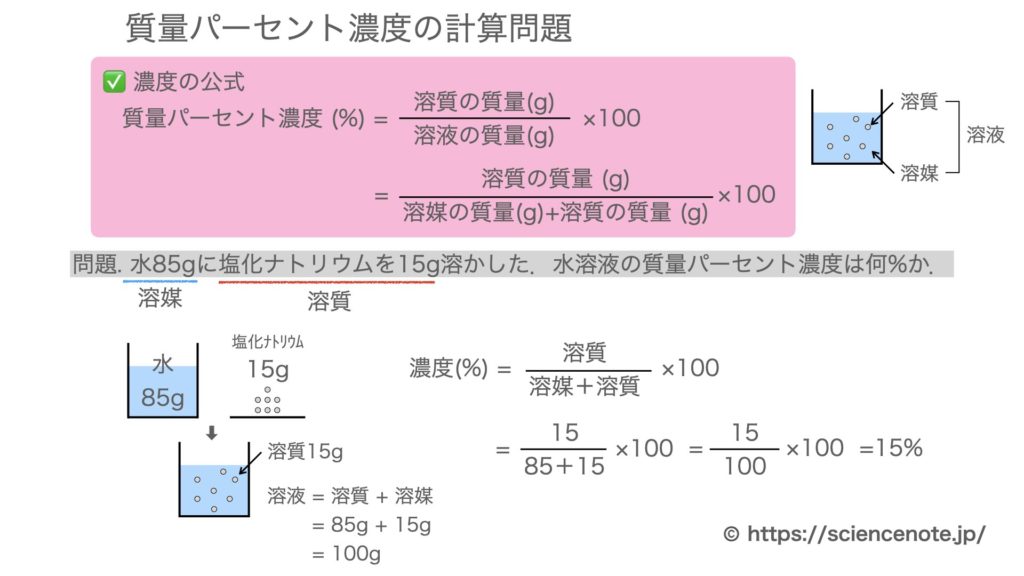



水溶液と質量パーセント濃度の計算問題 Sciencenote Jp




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
飽和水溶液中の溶質をモデル図で描き、平衡について理解することです。復習として、最高に濃い食塩水の濃度(%)も計算します。そして、次時『実習23:溶解度曲線』へつなげていきます。 他年度の実践 ・実験15 飽和水溶液と再結晶 1年(02年) · ①と②より、水酸化ナトリウム水溶液1Lを仮定した時の水酸化ナトリウムNaOHの質量と水酸化ナトリウム水溶液の質量が計算できました。 よって、求める質量パーセントは、 56g / 1400g × 100 = 4%・・・(答) となります。 いかがでしたか?水溶液の濃度計算を攻略する I まず義務教育で習った「溶液の濃度」を復習しよう. 食塩水100 g中に1 gの食塩が溶けているとき,食塩の濃度は1 %(w/w)である.
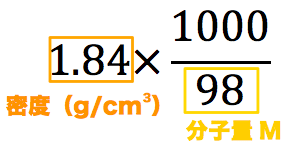



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




中学理科 計算問題 質量パーセント濃度の計算 Youtube
· 水溶液は濃度を求める計算が非常に大切です。ここで、全体・部分・割合の関係を理解することは、中学で学ぶこと全ての基本とも言えます。 しっかり学んで身につけておきたいところですからこのページを参考に整理してください。 目次 高校入試の「水溶液」の範囲で押さえておくべき25 Ⅰ.はじめに 水溶液濃度計算は,化学を学習していく上で必要不 可欠な要素の一つである. 濃度に関して平成年版小学校理科学習指導要領解 説理科編の小学校第5学年A「物質・エネルギー」(1) 「物の溶け方」には,「溶かす前の物の重さに水の重さ を加えた全体の重さと,溶かした後の水溶液の重さを 測定し,物を溶かす前と後でその重さは変わらいろいろな物質 密度計算 水溶液 濃度溶解度計算 気体 状態変化 基本問題 いろいろな物質 密度計算問題 身の回りの物質 気体1 気体2 気体3 水溶液の性質 水溶液の性質2 濃度計算問題 アンモニアの噴水実験 メスシリンダーの使い方 標準問題



1
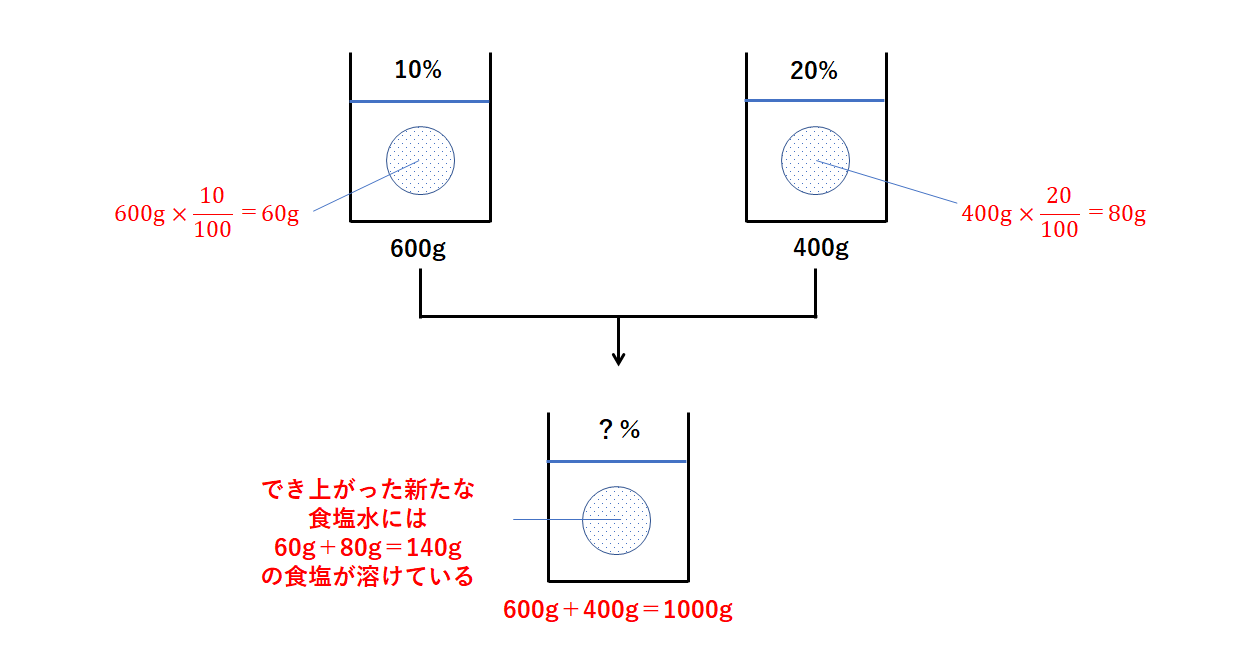



中1化学 水溶液 濃度 中学理科 ポイントまとめと整理
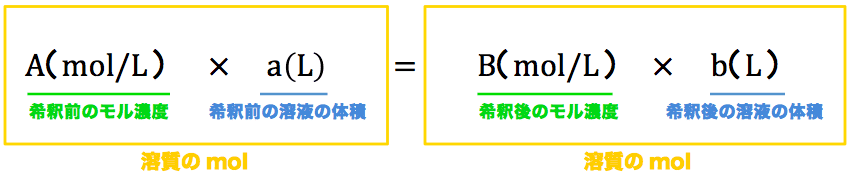
· 上記の計算方法に当てはめると、10%塩化ナトリウム水溶液の必要な量がわかっていないので 10×X=02×500 10X=100 X=10基本的な流れは、水酸化ナトリウム水溶液のときと同じです。 計算の流れを復習しながら、解いていきましょう。 モル濃度の計算では、溶質の物質量molが重要 まずは問題文を読んで、与えられている情報を整理していきましょう。 質量パーセント濃度が 98% 、密度が 18g/mL濃度は 25 % 質量は 30 g;



1




質量パーセント濃度の計算問題集 基本編 Menon Network
· (5)この水溶液の質量パーセント濃度は何%か。 解答 (1)125g (2)溶質 (3)溶媒 (4)エ (5)% (5)25/125 ×100=% 授業用まとめプリントは下記リンクからダウン透析液計算 ※単位のL →dLの換算が必要となるので注意! 濃度が585mg/dlのNaCl(分子量:58.5)水溶液中のNa+の当量濃度はいくつか。 濃度が1170 mg/dLのNaCl(分子量:585)水溶液の当量濃度はいくつか。 濃度が1110 mg/dLのCaCL2(分子量:111)水溶液の




Learn De Leon 家庭教師 ランデレオン 理科 計算 公式 質量パーセント濃度 割合 Facebook




4 6 溶液の濃度 おのれー Note




中和滴定による濃度の決定について計算式の意味がわかりません 理科 苦手解決q A 進研ゼミ高校講座
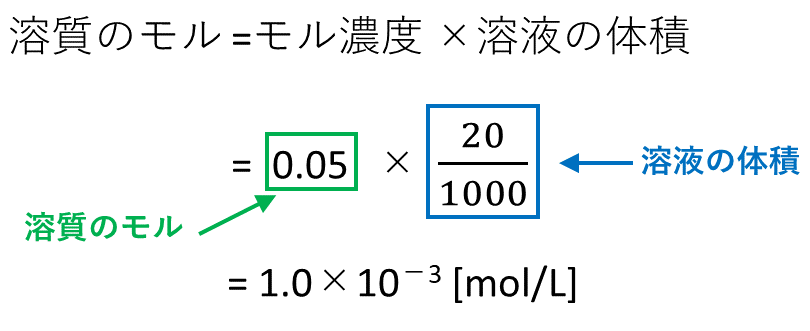



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




1 30g 3100g See How To Solve It At Qanda
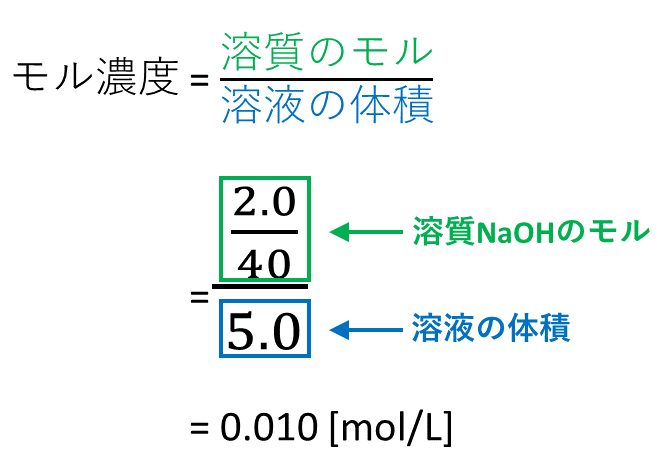



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




中学理科 水溶液の濃度と飽和 溶解度 偏差値40プログラマー




Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ
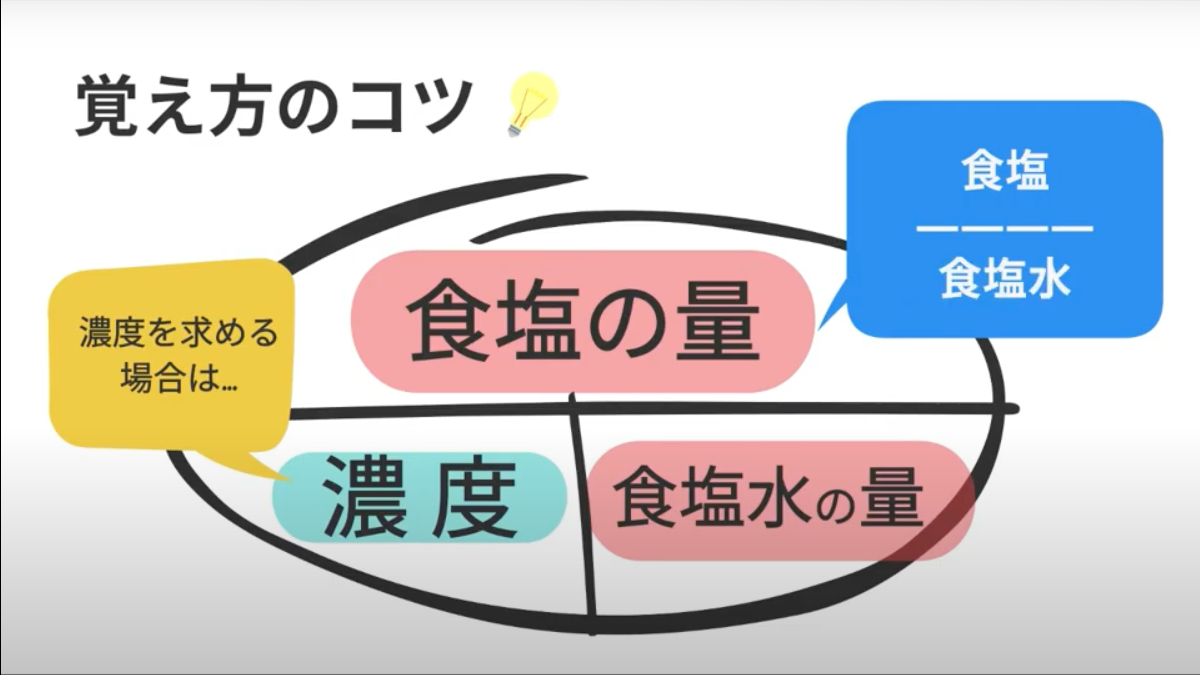



中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン



基礎化学3 溶液




質量パーセント濃度の計算問題集 応用編 Menon Network
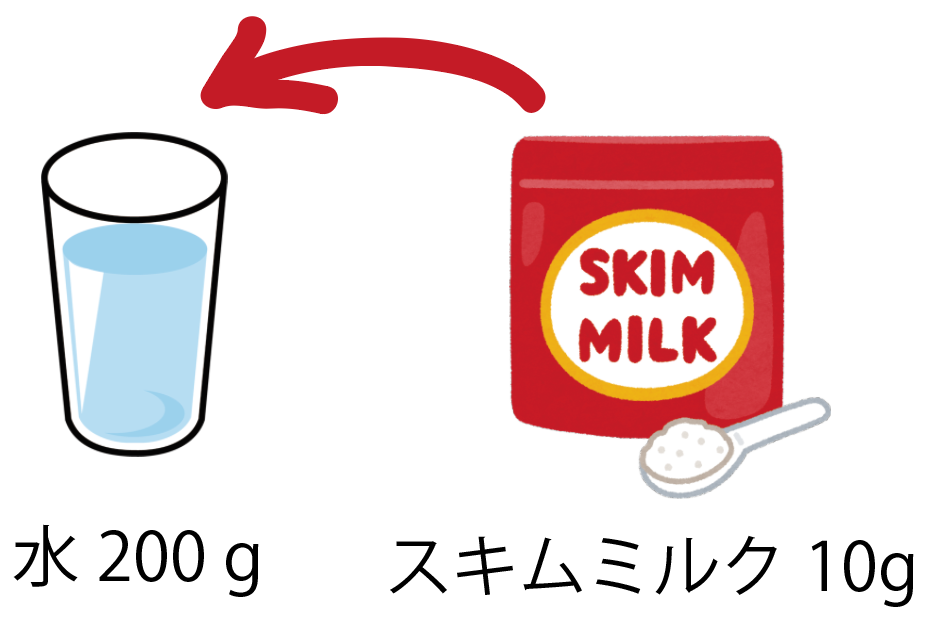



これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく
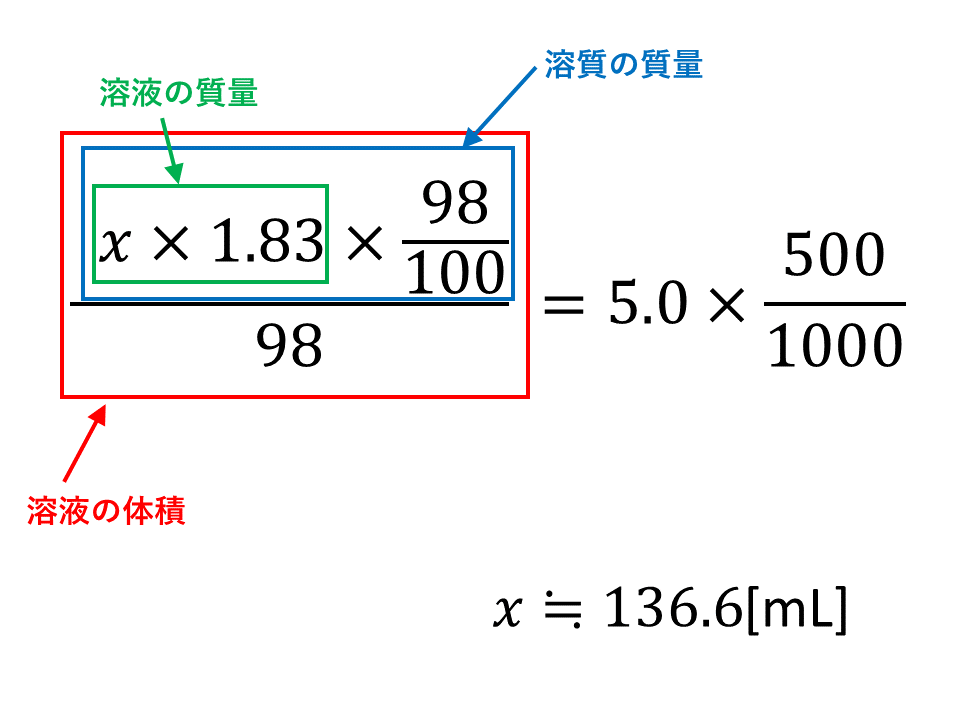



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




濃度算 混ぜる 高精度計算サイト



1




食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun
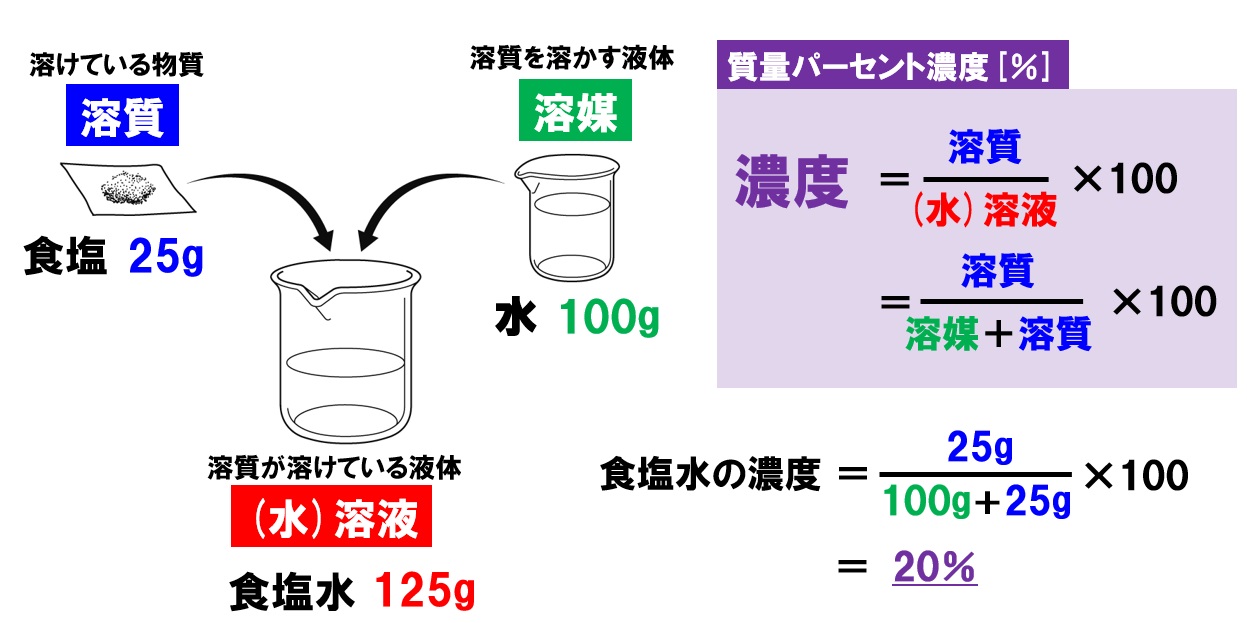



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく



溶質を求める
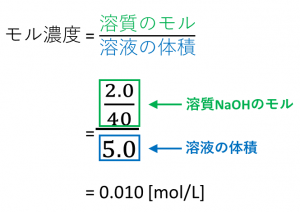



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine
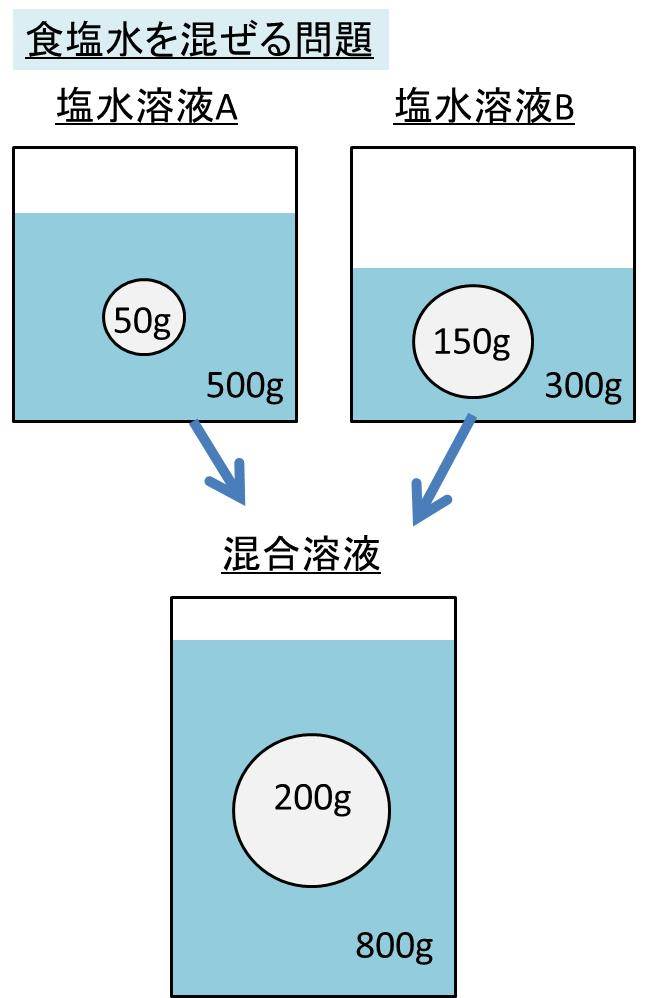



Spi 異なる濃度の食塩水を混ぜる問題の計算方法 濃度算




モノマナビ研究所




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく



看護学部の化学講義 9 濃度のあらわし方 Life Chemistry




モル濃度 Molar Concentration Japaneseclass Jp
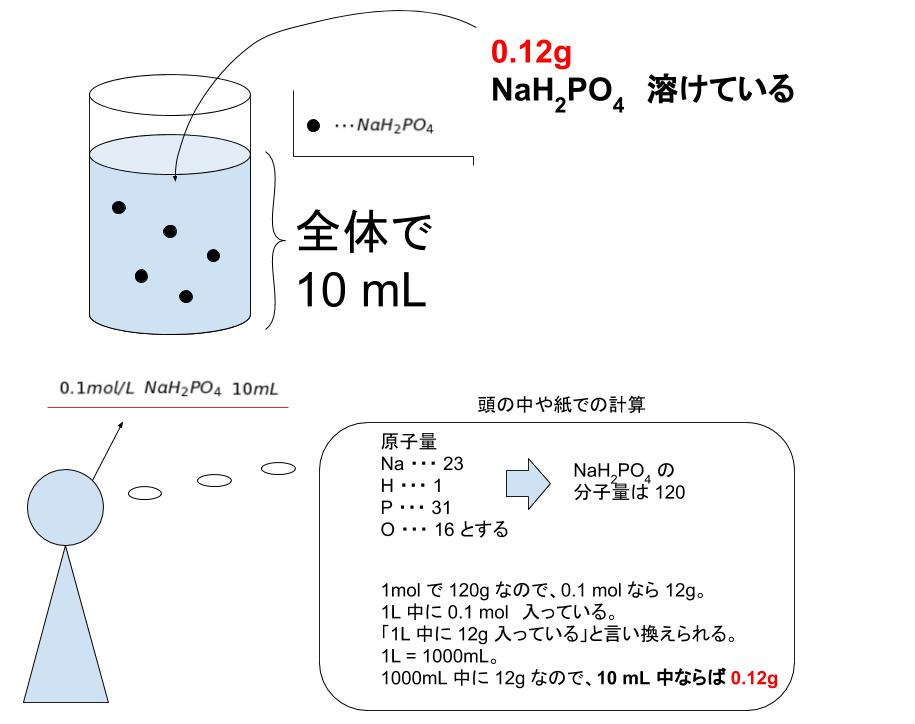



溶液の濃度計算 薬学 これでok
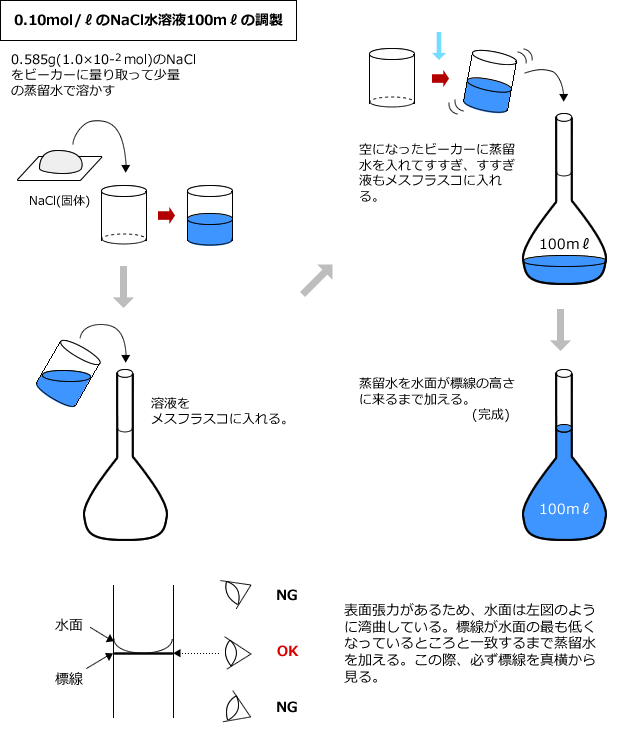



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




質量パーセント濃度




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット



モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ




0g Descubre Como Resolverlo En Qanda
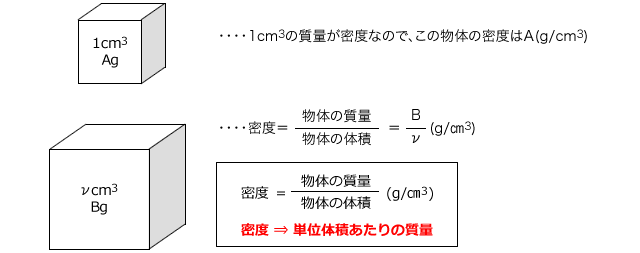



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ



基礎化学3 溶液



実習21 水溶液の濃度 1年理科 化学 Takaの授業記録12
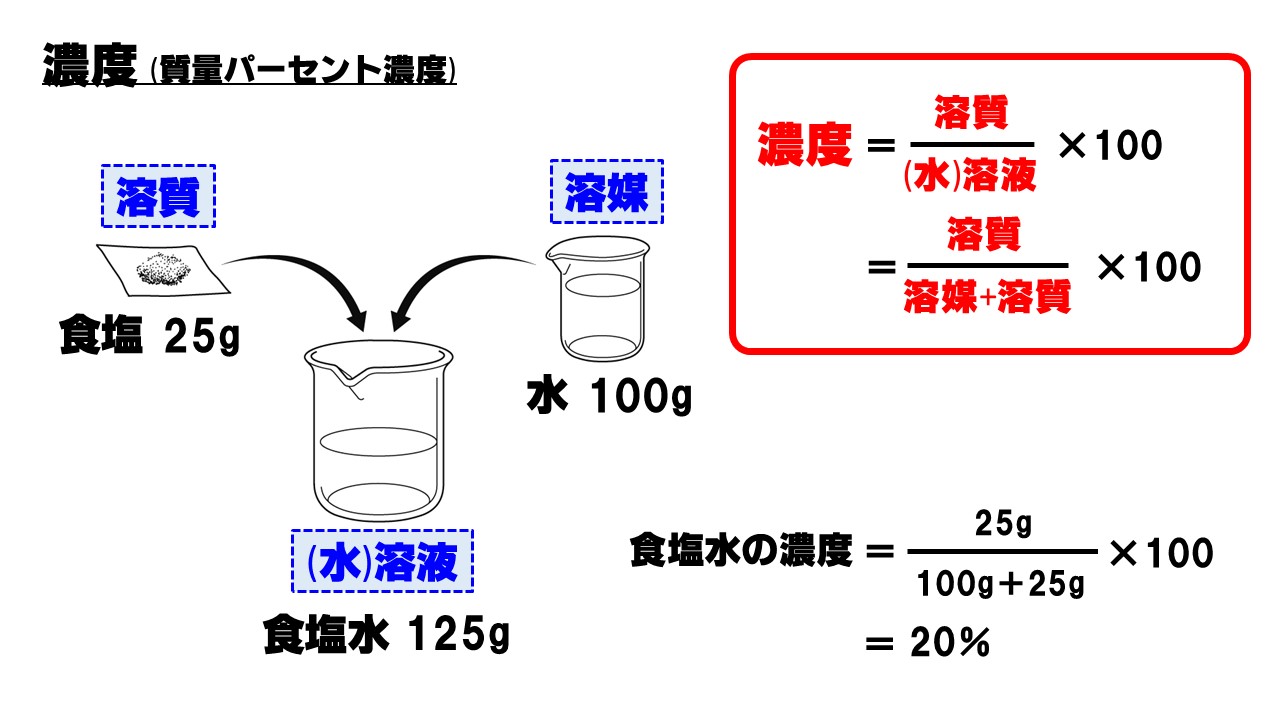



中1理科 濃度 質量パーセント濃度 のポイント Examee



濃度の応用




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




中1 理科 中1 32 質量パーセント濃度 Youtube




溶液の濃度 無料で使える中学学習プリント




中1 理科 化学 濃度の計算方法 14分 Youtube




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月




溶液の質量パーセント濃度の求め方と比重を利用した計算問題




質量パーセント濃度の計算問題集 基本編 Menon Network




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu
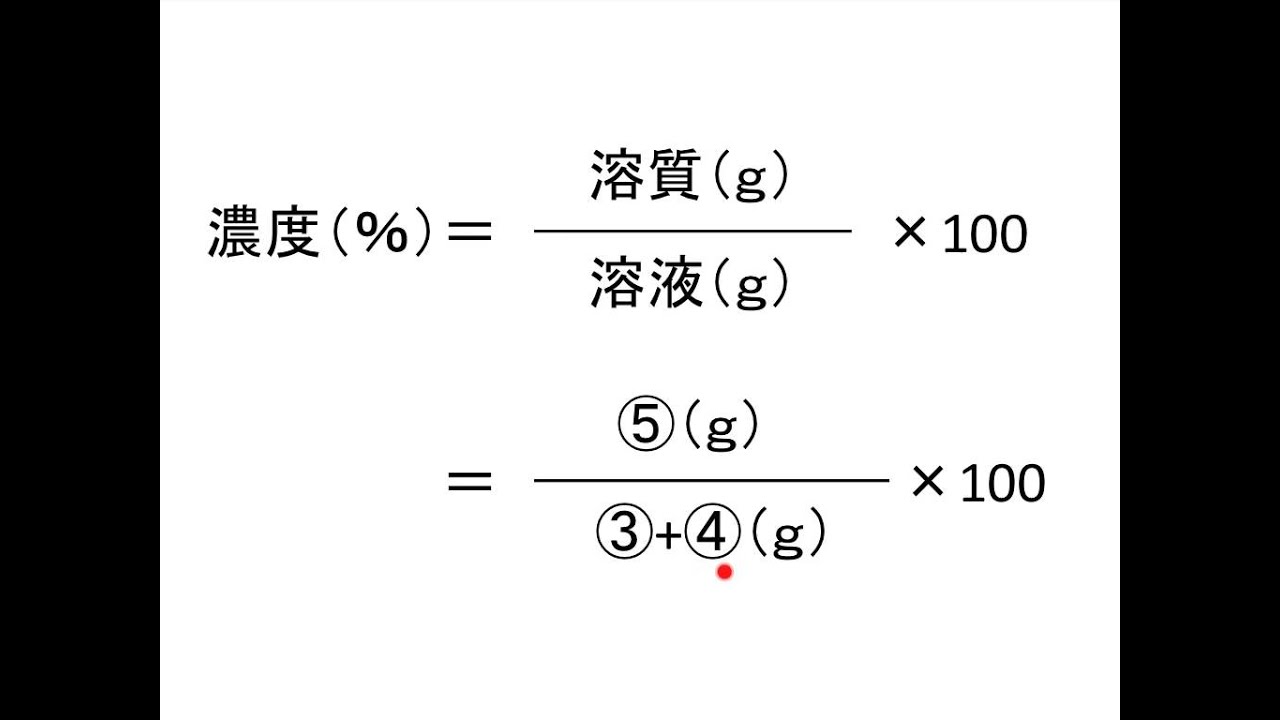



濃度の求め方 絵で覚えよう Youtube




食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun




質量パーセント濃度の求め方とモル濃度の違い




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
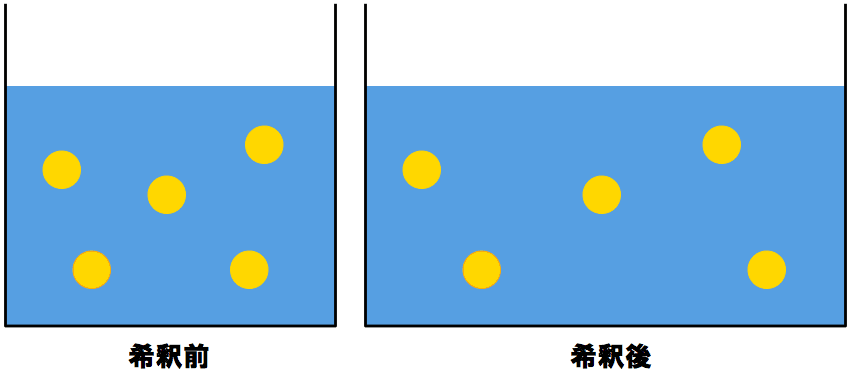



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ



1




高校化学 質量モル濃度 映像授業のtry It トライイット




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




中1理科 濃度の計算 映像授業のtry It トライイット
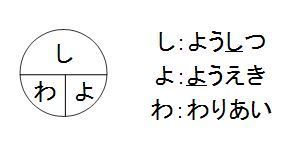



しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート
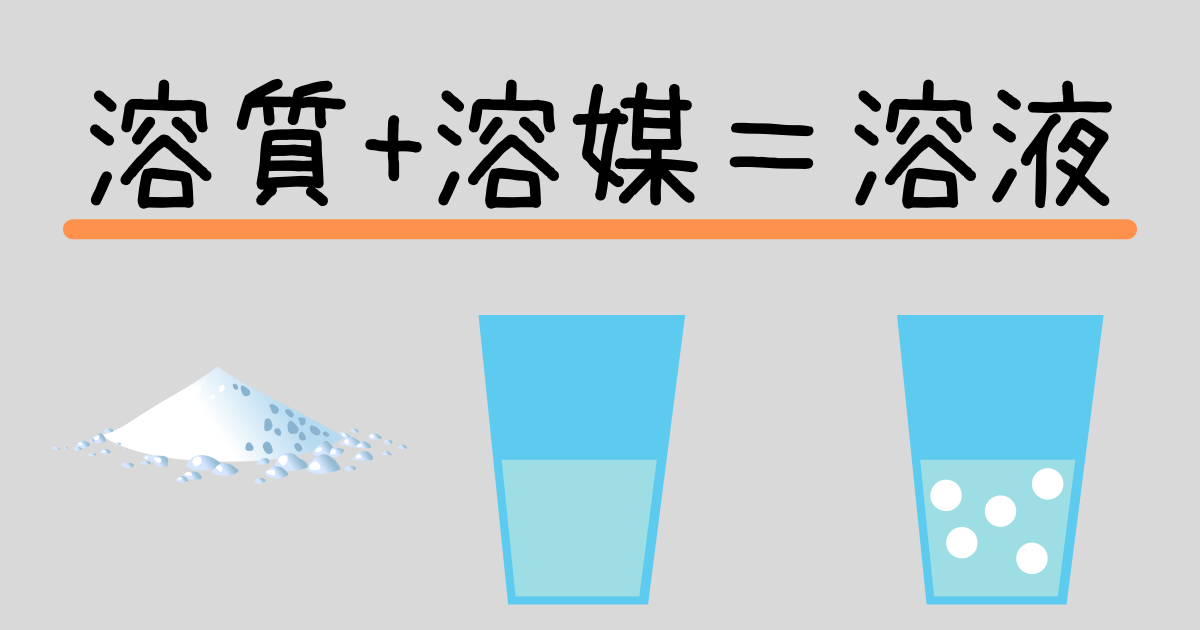



水溶液と質量パーセント濃度の計算問題 Sciencenote Jp




4 6 溶液の濃度 おのれー Note
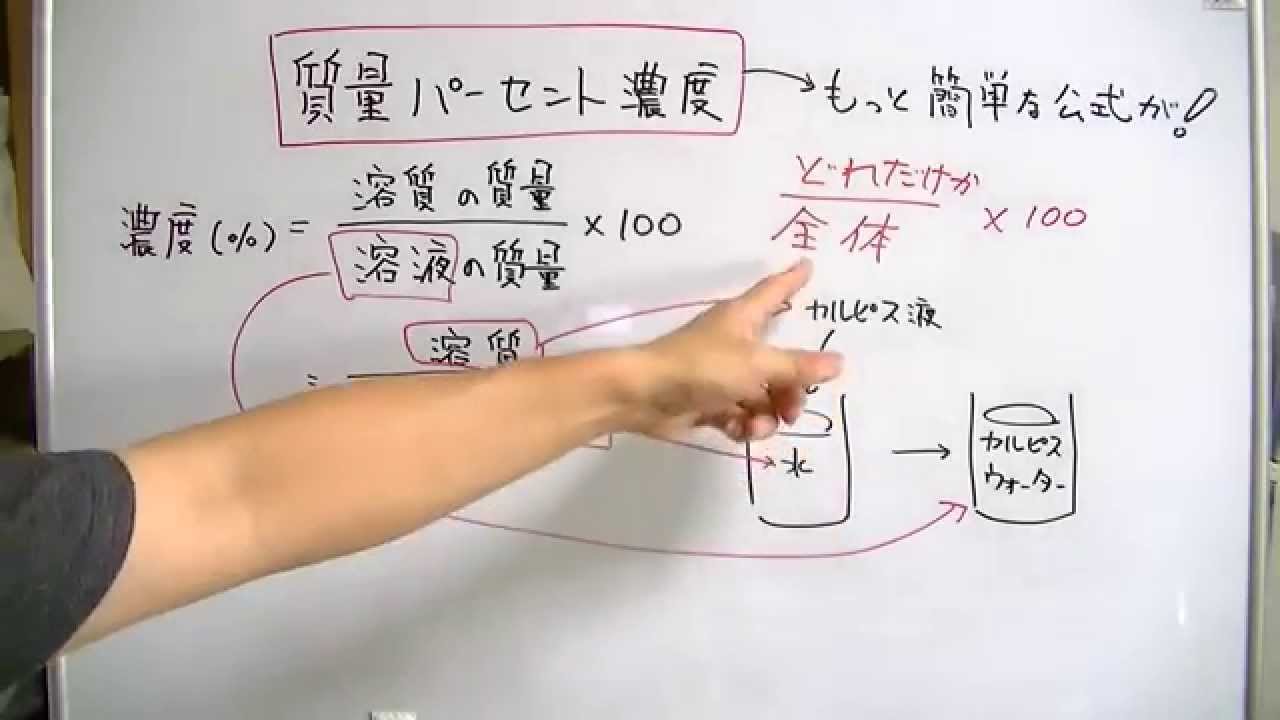



質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube
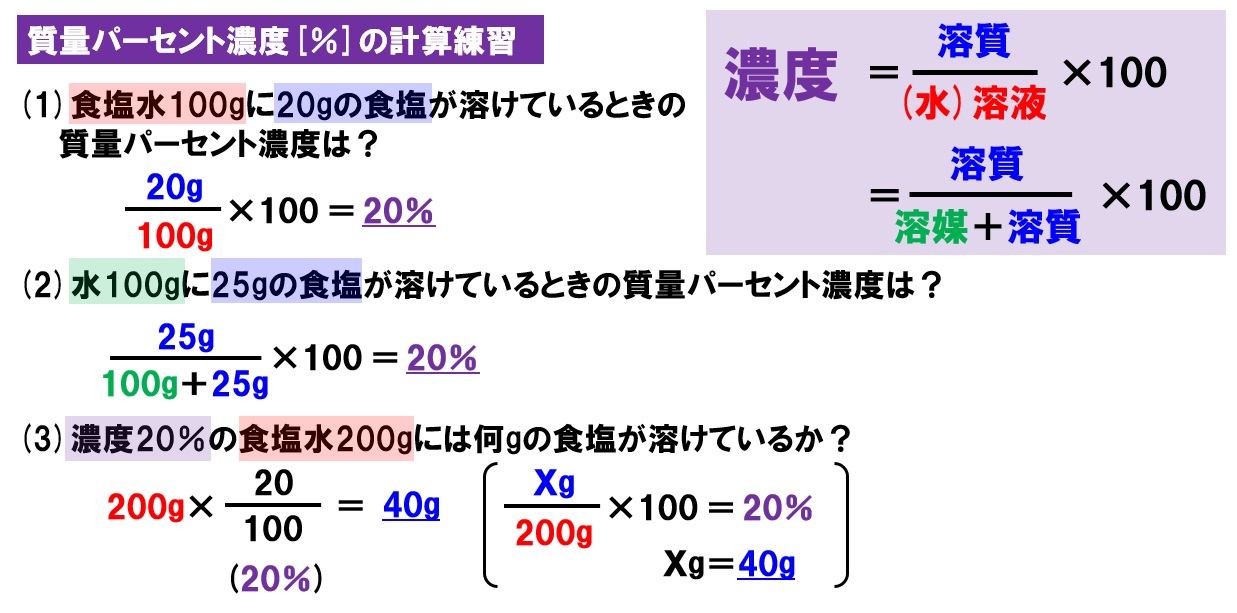



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu
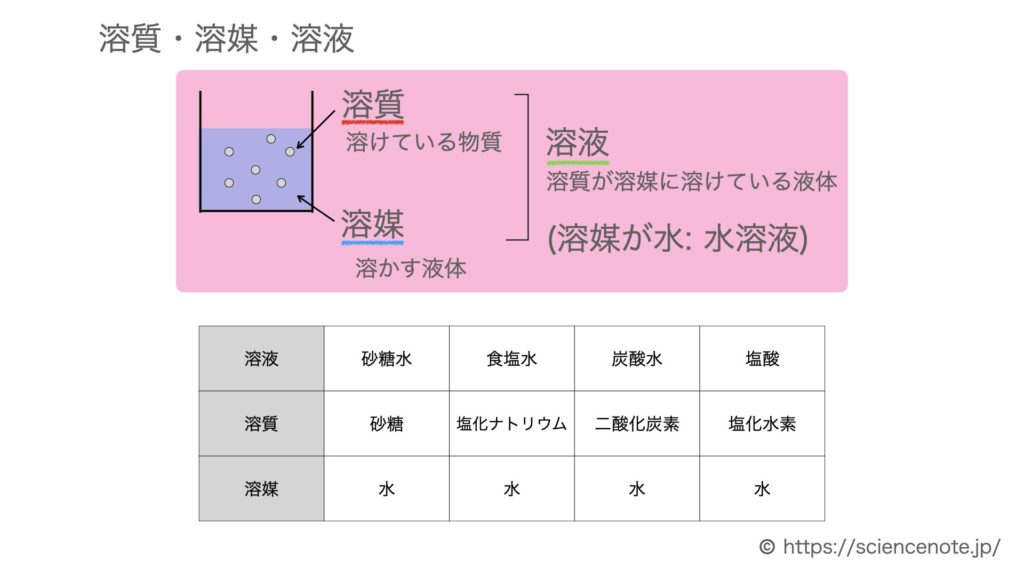



水溶液と質量パーセント濃度の計算問題 Sciencenote Jp




Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




医療工学科の化学講義 16 溶液濃度計算問題演習 Life Chemistry




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン




濃度計算を素早く 化学がちょっとだけ好きな社労士




4 6 溶液の濃度 おのれー Note




質量パーセント濃度の計算問題集 基本編 Menon Network



Www Jupiterimages Com
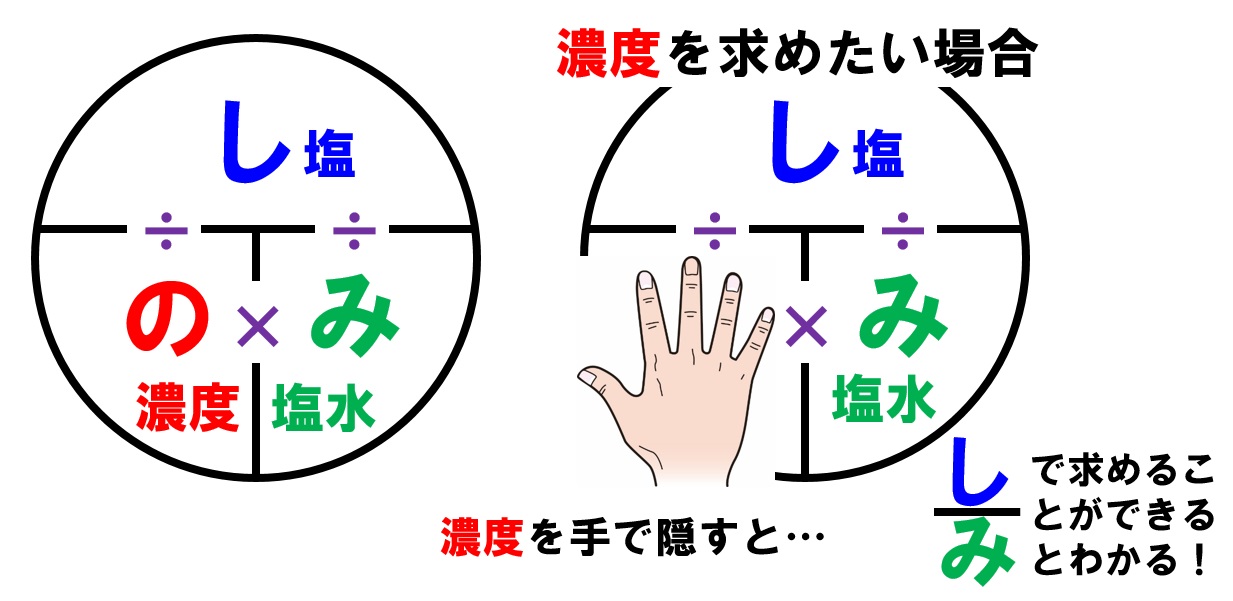



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




質量パーセント濃度に関する問題です 0 4がどこから出てきたのかわかりません Clear
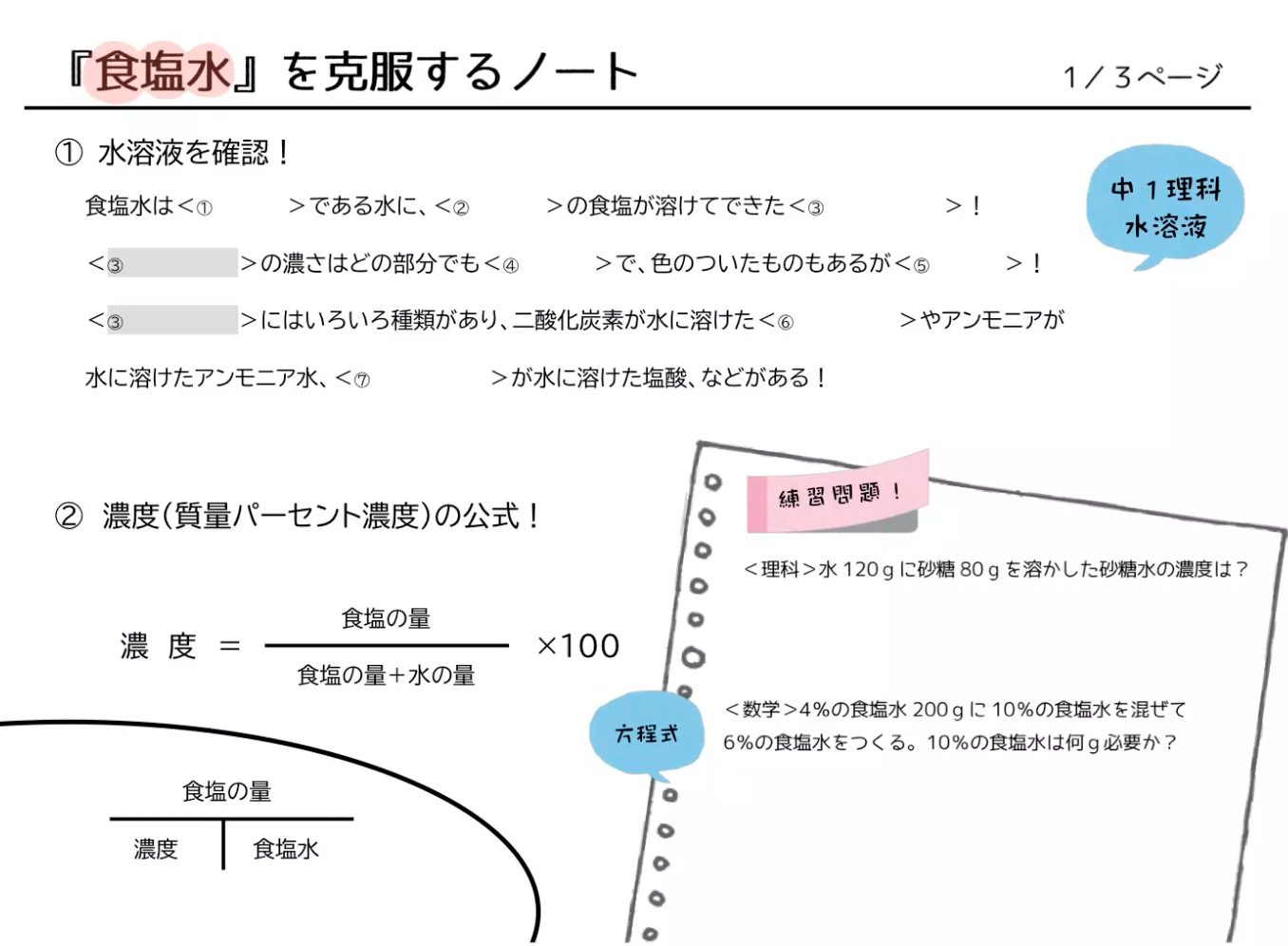



中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




Science 物質 溶解度と濃度 働きアリ



医療工学科の化学講義 16 溶液濃度計算問題演習 Life Chemistry




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット
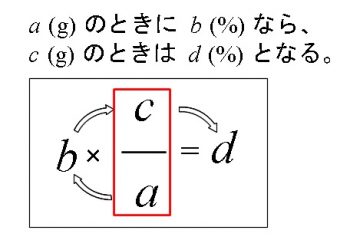



溶液の質量パーセント濃度の求め方と比重を利用した計算問題



中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす



基礎化学3 溶液




4 6 溶液の濃度 おのれー Note




アルコールでコロナ対策 Wt Vol 濃度換算機



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす




この問題の一つ目の モル濃度を求める計算の部分で 1 1 11と 1 1000が何を Clear




見にくくてすいません 化学の質量パーセント濃度計算で Clear




水 酸化 ナトリウム 分子量 ナトリウム Amp Petmd Com



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ



コメント
コメントを投稿